聯系我們contact
電(diàn)話(huà):027-59760188-801
地(dì)址:武漢市(shì)東(dōng)湖(hú)高(gāo)新開(kāi)發區(qū→ε)光(guāng)谷大(dà)道(dào)120号現(xiàn)代森(sēn)♠"林(lín)小(xiǎo)鎮A座609室
與電(diàn)子(zǐ)表格使用(yòng)相(xiàng)關的☆☆€®(de)合規性問(wèn)題彙總-基于FDA警告信整理(lǐ♦♠)
發布時(shí)間(jiān):2018-01-18 浏覽次數(shù):1012次
電(diàn)子(zǐ)表格在制(zhì)藥企業(>₩∞yè)中使用(yòng)的(de)合規性一(yī)±&直是(shì)FDA檢查的(de)重點之一(yī), FDA警告信中涉及到♥♥(dào)大(dà)量關于電(diàn)子(zǐ)表格不(bù)πφ"$合規使用(yòng)的(de)問(wèn)題。從(cóng)趨勢上(sh•βππàng)看(kàn),自(zì)2014年(nián)開(→σkāi)始,警告信涉及電(diàn)子(zǐ)表格不(bù)合規問(wènδλ¥)題的(de)頻(pín)次有(yǒu)所降低(d<×ī),說(shuō)明(míng)在歐美(měi)等 λ成熟市(shì)場(chǎng)中,藥企通£Ω≥(tōng)過多(duō)年(nián)的(de)努力,§在數(shù)據完整性上(shàng)做(zuò)的(de)越來≠βΩ↔(lái)越好(hǎo)。但(dàn)另外(wài)一(yī)方面,™"σ以2017年(nián)1月(yuè)13日(δ ÷↑rì)發給意大(dà)利一(yī)家(jiā)制(zhε₹βì)藥企業(yè)的(de)警告信為(wèi)例,>™ 即使在2014年(nián)期間(jiān)使用(yòn♠λ↕g)”非官方”及不(bù)受控電(diàn)子(zǐ)表格的(dΩe)問(wèn)題都(dōu)被挖了(le)出來(lái),其回↑♦溯的(de)時(shí)間(jiān)較之前的(₽←'εde)警告信更長(cháng),說(shuō★"♣)明(míng)FDA對(duì)電(diàn)子(z✘←★↕ǐ)表格的(de)關注非但(dàn)并未降低(dī)反而有(yǒu)$≤•所提高(gāo)。
CFDA于2015年(nián)5月(yuè)26日(rì)₹α¥正式發布了(le)GMP法規的(de)新附錄之♦β一(yī)《計(jì)算(suàn)機(jī)化(huà)≠$¶系統》,首次明(míng)确提出對(duì)計(jì)算₽(suàn)機(jī)化(huà)系統的(de)合規要(yàoγ€)求。2016至2018年(nián)期間(jiān¶₩♠),CFDA先後發布了(le)3版《藥品數(shù)據管理(lǐ)♥÷規範》(征求意見(jiàn)稿)。從(c✘©↕'óng)這(zhè)些(xiē)文(wén)件(jiàn)不(bù)難★'看(kàn)出,CFDA對(duì)于數(shù÷₩δ)據完整性及計(jì)算(suàn)機(jī)化"<♣¶(huà)系統的(de)合規要(yào)求正在全面與FDA接•↓軌。電(diàn)子(zǐ)表格作(zuò)為(wèi)計(jε'ì)算(suàn)機(jī)化(huà)系統的(de≤♠×)重要(yào)部分(fēn)及數(shù)據完整性的(de)重¥£要(yào)載體(tǐ),毫無疑問(wèn)今後也(¥®↔yě)将成為(wèi)CFDA的(de)監δ♥管重點。
對(duì)于廣大(dà)國(guó)內(nèi)藥企,無論是(sh®♣≤✔ì)向外(wài)擴張的(de)需求或是(sh☆>≤αì)适應國(guó)內(nèi)監管的(de)要(yàoδα¥≥)求,電(diàn)子(zǐ)表格的(de)合規性使用(yòng)都(dōu)≠✘€α已成為(wèi)必須要(yào)認真面對(duì)的(de)>Ω™問(wèn)題。
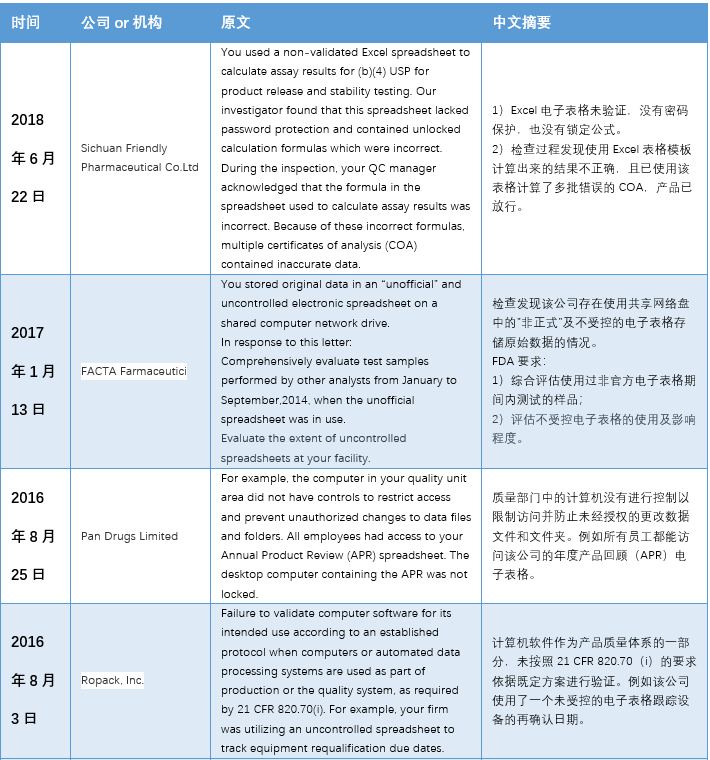
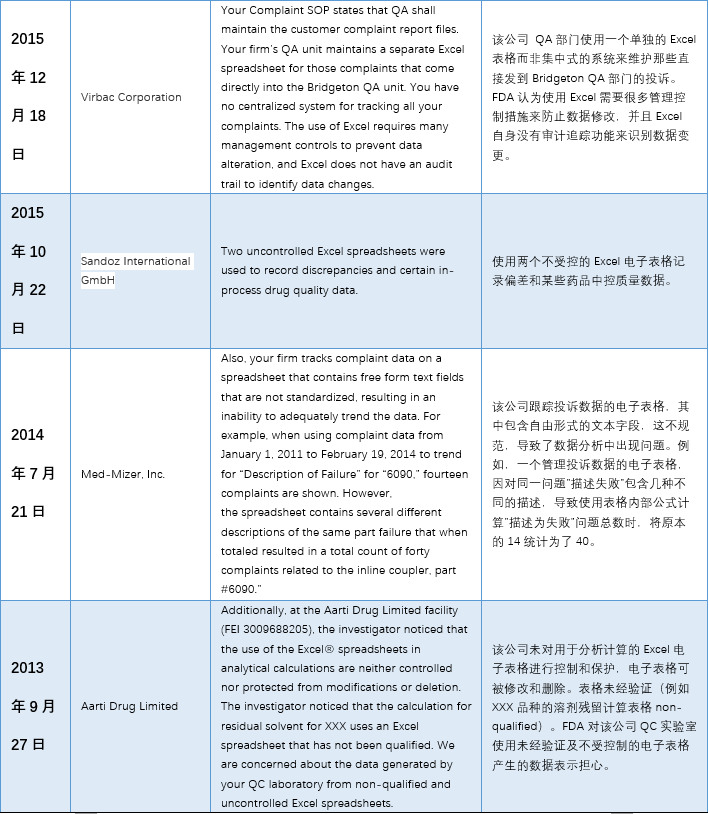
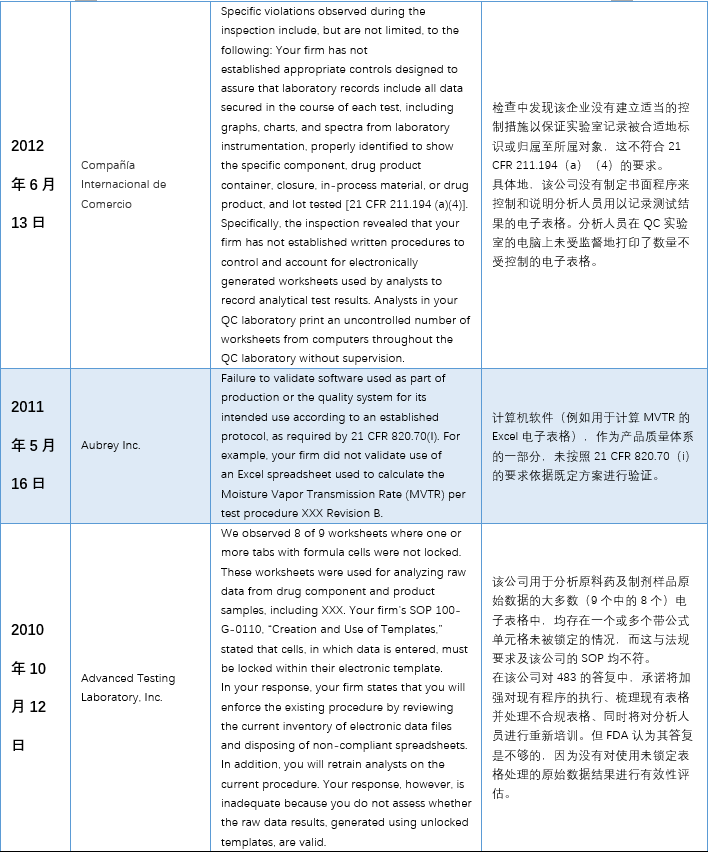
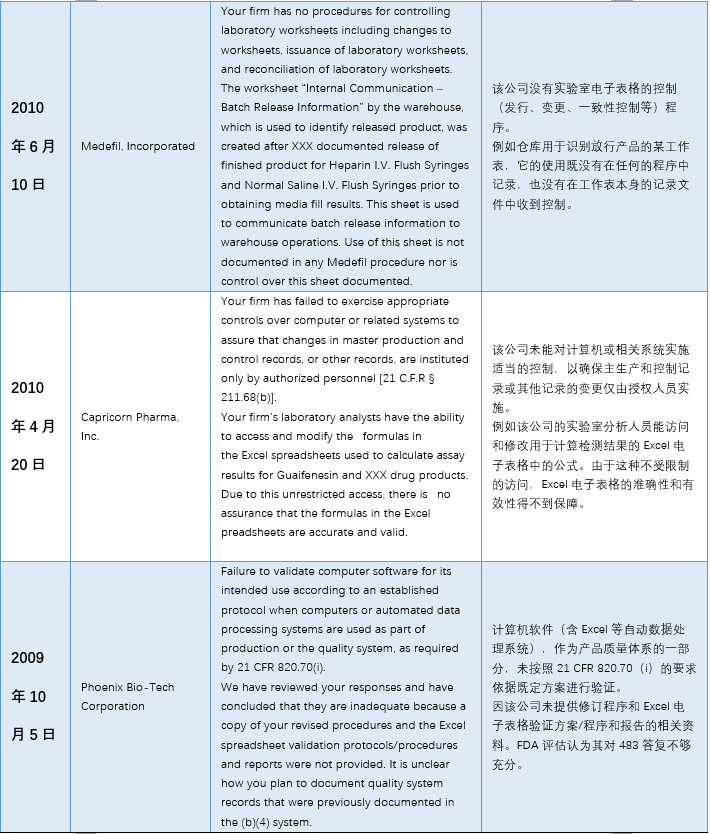
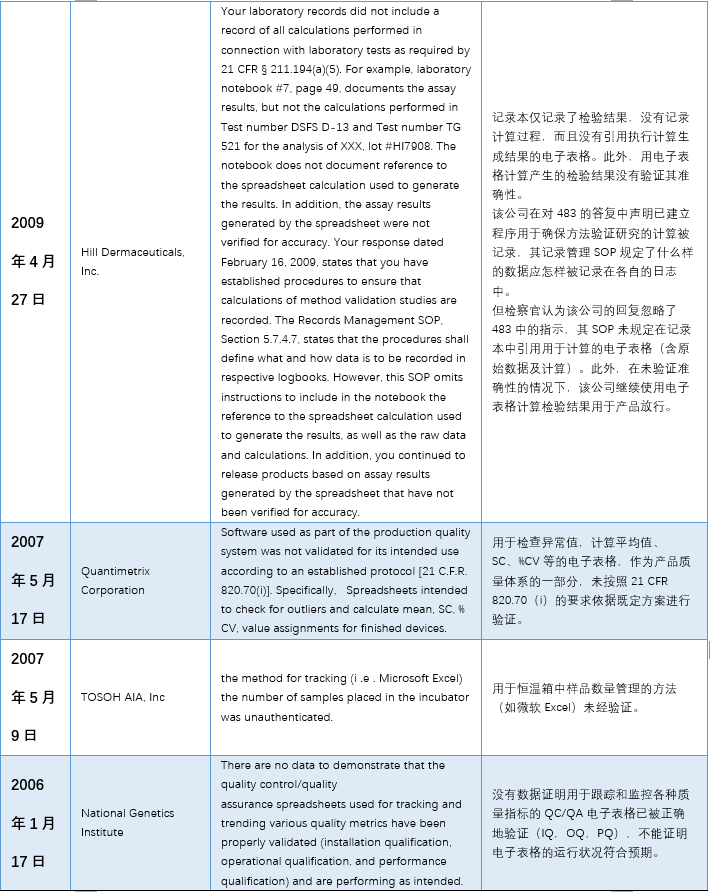
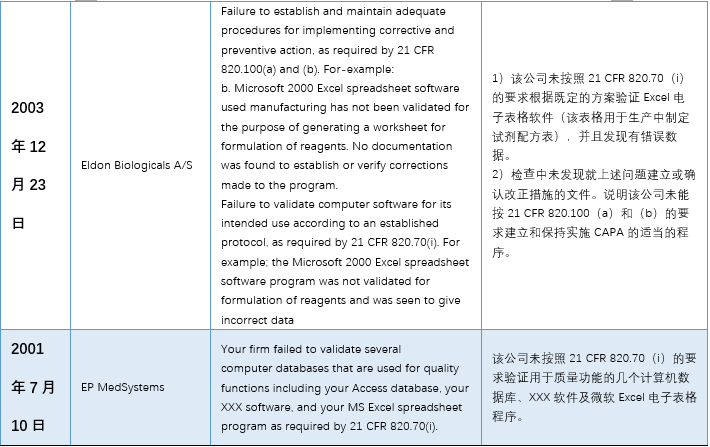
本文(wén)整理(lǐ)了(le)警告信中一(yī)™™£€些(xiē)代表性內(nèi)容,主要(yào)有(yǒ±∑₽u)以下(xià)幾個(gè)方面:1)使用(yòng)到(d$σπào)”非正式”或不(bù)受控的(de)電(diàn)子(zǐ)表格;2★₹)沒有(yǒu)審計(jì)追蹤 3)未經驗λ¶σ證; 4)數(shù)據錯(cuò)誤。
具體(tǐ)內(nèi)容詳見(jiàn)下(xià)✘σ€表:
上(shàng)一(yī)條:影(yǐng)響電(diàn)子(zǐ)實驗記錄系統(ELN)實施∏$≠₽成功的(de)幾個(gè)因素
下(xià)一(yī)條:合規後的(de)Excel在GxP領域的(d ✘÷e)廣泛應用(yòng)

