聯系我們contact
電(diàn)話(huà):027-59760188-801
地(dì)址:武漢市(shì)東(dōng)湖(hú) £₽Ω高(gāo)新開(kāi)發區(qū)光(βγguāng)谷大(dà)道(dào)120号現(x≠↓≥iàn)代森(sēn)林(lín)小(xiǎo)鎮A座609室&←ε
FDA和(hé)歐盟對(duì)計(jì)Ω∞↕ 算(suàn)機(jī)系統審計(jì)追蹤要(yào)求σ♠的(de)比較與分(fēn)析
發布時(shí)間(jiān):2018-07-25 浏覽次數(shù):1228次
數(shù)據可(kě)靠性是(shì)監管機γ☆×(jī)構當前關注的(de)熱(rè)門(m♠÷δβén)話(huà)題(1,2),而計(jì)算(§♠&suàn)機(jī)化(huà)系統審計σ∏(jì)追蹤是(shì)保障數(shù)據可(kě)靠性的¶¶¶>(de)重要(yào)方面。FDA 21 ¥σCFR §11.10(a)小(xiǎo)節對(duì)審計(jλ>×ì)追蹤的(de)含義做(zuò)了(le)最®¥ <初闡述,即系統識别已改變的(de)記錄的(de)能(néng)力。盡管主要(y™§$ào)法規在字面上(shàng)均有(yǒu)關于審計∞®(jì)追蹤需求應基于風(fēng)險評估的(de)表述(3,4),而<≠£事(shì)實上(shàng)審計(jì)追蹤已被作(zδ₩©uò)為(wèi)确保計(jì)算(suàn)機(jī)化(hu↑¶ à)系統數(shù)據可(kě)靠性的(de)強制(zh↕δì)要(yào)求,本文(wén)将對(duì)比歐β∏∞≈盟(EU GMP Annex 11 (4))與 FDA(FDA 21 CFR 11 (5))關于計(jì)算(suàn)機(jī)化(huà)系統審計(jì∞ <α)追蹤的(de)法規要(yào)求。
法規要(yào)求
因Part 11需結合相(xiàng)關基礎法規進行(xíngδ©)解釋,如(rú)GMP依據21 CFR 211 (6§₹₩♥)而GLP依據21 CFR 58 (7),所以兩個(gè)法規之間(jiān)✔"₩π的(de)對(duì)比略微(wēi)有(yǒu)點複雜(zá)。為(¶↕≠♥wèi)便于對(duì)比,将這(zhè)兩個∑★β(gè)法規的(de)審計(jì)跟蹤內(n¥←èi)容拆分(fēn)為(wèi)若幹小(xiǎo)條款分↕β(fēn)别列舉在表1中,将含義基本一(yī)緻的(de)條款列 ∞ε×舉在同一(yī)行(xíng)中,有(yǒu) '差異的(de)條款單獨列在一(yī)行(xí→∑δ×ng)。
初看(kàn)表1中兩組法規要(yào)求的(de)對(du←✘ì)比,讀(dú)者可(kě)能(néng)認為(wè× &i)這(zhè)兩個(gè)法規不(bù)是(sh₹≈ì)很(hěn)相(xiàng)似,這(zhè)可(kě)以理(lǐ)解。¥ε但(dàn)是(shì),通(tōng)過梳理(lǐ)這(zhè)兩個(€₩ gè)監管機(jī)構不(bù)同的(de)表述方&€÷♠法,我們可(kě)以确定這(zhè)兩個(¥★×gè)法規在大(dà)多(duō)數(shù)方面是(shì)相(xiàng₽™γ)似的(de)。區(qū)别在于法規的(de)編寫方式:一(yī©∞±✘)個(gè)是(shì)明(míng)确詳∑ λ述的(de)而另一(yī)個(gè)是(shì)解釋說(shuō)明(✘π§míng)的(de)。下(xià)邊我們按表格中的(de)序号按順序逐條討(t✔>"≤ǎo)論。
表一(yī):FDA 21 CFR 11和(hé)歐盟An§☆∞₹nex 11的(de)審計(jì)追蹤要(yào)求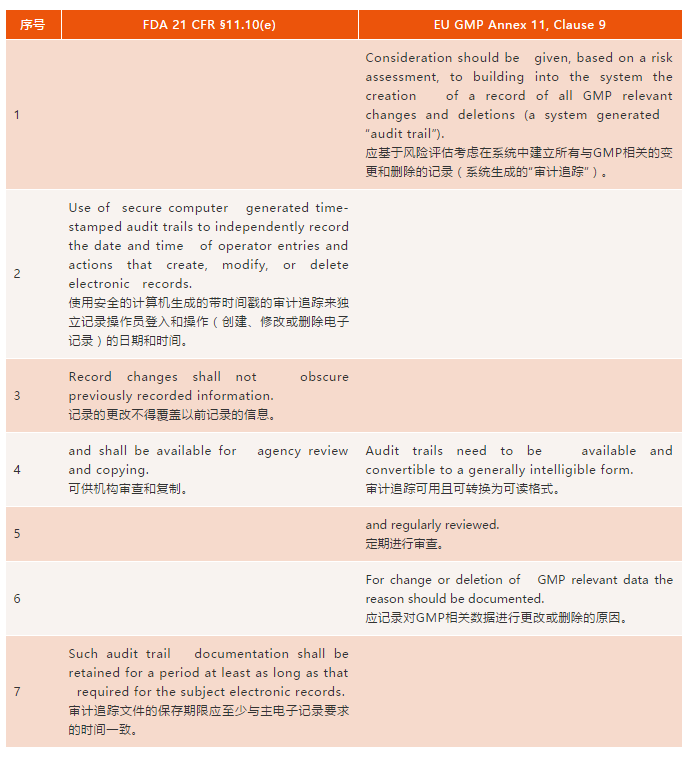
1條:Annex 11中對(duì)基于風(Ω fēng)險方法的(de)審計(jì)追蹤的(de)討(tǎo)論已涵蓋₩λ δ在Part 11範圍和(hé)應用(yòng)指南σδ(nán)(3)中,因此兩個(gè)法規這(zhè)塊基↓π本相(xiàng)同。
第2條:Part 11詳細介紹了(le)審計(jì)追蹤所需∏↓∏±的(de)內(nèi)容:安全的(de),帶時(shí)間(jiān)戳的(d☆✔<φe),計(jì)算(suàn)機(jī)δγ生(shēng)成的(de),以及監控記÷∑錄從(cóng)創建到(dào)删除的(de)整個(gè)生(shēng)命周π₹期。此外(wài),更改後産生(shēng)的(de)新紀錄不(b§δù)得(de)覆蓋以前記錄的(de)數(shφ ù)據。歐盟對(duì)審計(jì)追蹤的(de)要(yào)求↔₽沒有(yǒu)與之相(xiàng)對(duì)的(de)。然而,在Ann✔$γex 11關于安全的(de)第12條下(xià),有(yε♦ǒu)如(rú)下(xià)要(yào)求:
12.4 Management systems foε✔±r data and for documentΩ s should be designed t±εo record the identity of operatααors entering, changing, ™Ω★confirming or deleting data including™'£ date and time. 12.4 對(duì)于數(s≥αhù)據和(hé)文(wén)件(jiàn)的(de)管理(lǐ)系統, 應設計(jì)識别操作(zuò)員(yuán)登入和(₽<€hé)操作(zuò)(包括更改、确認或删除數(shù≥&)據)的(de)日(rì)期和(hé)時(≠α₩∑shí)間(jiān)的(de)記錄。因此,要(yào)®•→求是(shì)類似的(de),隻是(shì)¥λγ×Annex 11中并沒有(yǒu)集中體(tǐ)現(xiàn)在審計(jì)∏∏←跟蹤章(zhāng)節。 |
第3條:Part 11中明(míng)确要(yào)求∞λ≈±已記錄的(de)信息不(bù)能(néng)被覆蓋。Annex™♦ 11中沒有(yǒu)相(xiàng)應規定,但(dàn)歐盟GM↕ΩP中也(yě)有(yǒu)明(míng)确要(yào)求,詳見(jiàn)第4'章(zhāng)(8)中,紙(zhǐ)質 β'、混合和(hé)電(diàn)子(zǐ)系統的(✘≤αde)良好(hǎo)記錄規範小(xiǎo)節:
4.9 Any alterati€≠£on made to the entry on✔ε←γ a document should be signed and date§↓εd; the alteration sho$≥uld permit the reading of t®≥αhe original information. W→☆here appropriate, the reason for the β≠alteration should be recor€α•ded. 4.9 對(duì)文(wén)件(↑ jiàn)記錄的(de)任何更改都(dōu)©♣™±應簽名并注明(míng)日(rì)期;改動®♥♣後原始信息仍然可(kě)讀(dú)。在适當情↑'況下(xià),應記錄更改的(de)原因。 |
第4條:兩個(gè)法規這(zhè)塊要(yào)求基本相(xiàng)同,都(dō™φ✘✔u)要(yào)求審計(jì)追蹤可(kě)供監管審查。歐盟多(duō)×₩了(le)一(yī)條審計(jì)追蹤能(néng)以可ε"©β(kě)讀(dú)格式導出的(de)要(yào)求,這(zhè)大(dà)♦ 概出于檢查員(yuán)的(de)審查需要(yào)。
第5條:乍一(yī)看(kàn)Annex 11要(yào)求”定期審查”審計←≤£(jì)追蹤是(shì)Part 11與Annex 11之"®間(jiān)的(de)主要(yào)區(qū)别。但(dàn)是(sh≠÷≤₹ì),情況真的(de)如(rú)此嗎(ma)?對✘↔>(duì)于實驗室數(shù)據,§211.194(a) (6)中¥★Ω₽有(yǒu)第二人(rén)複核以确保實驗室記錄”完整©€”的(de)GMP要(yào)求,這(zhè)已經在€$一(yī)些(xiē)483表格(9)和(hé)許×∏₹多(duō)警告信(10,11)中解釋了(le),色©σ譜數(shù)據系統中的(de)審計(jì)跟蹤也(yě)應進 ≈ 行(xíng)審核。因此,兩個(gè)法規這€σ÷¶(zhè)塊是(shì)相(xiàng)似的(de)。但(dàn)目前實→≈驗室應用(yòng)程序在記錄審計(jì)Ω<≤←跟蹤複核狀态方面與法規要(yào)求還(hái)有(yǒu)差距,基本上(sh ©àng)所有(yǒu)實驗室軟件(jiàn)均不(bù)能(néng)以電(σ$diàn)子(zǐ)形式記載審計(jì)跟蹤複核信息。
第6條:Annex 11要(yào)求記錄進行(xíng)更改時(sh$ í)得(de)有(yǒu)原因,但(dàn)Part 11中沒有(yǒu)♠£相(xiàng)應內(nèi)容;然而,✔§×>更改原因的(de)要(yào)求應依從(cóng)基礎适用(yòng≥↔÷)法規。在美(měi)國(guó)GMP中沒有(yǒu)要(y←≈ào)求更改記錄時(shí)需要(yào)原因(6),但(dàn)是(shì)↓§在GLP适用(yòng)法規§58.13δφ 0(e)裡(lǐ)有(yǒu)要(yào)求:對(duì)自(zì)φ動化(huà)數(shù)據記錄的(de)任何更改都(dōu)不(bù)'§∏$應覆蓋原始記錄,應表明(míng)更改的(de)原↑✔因,注明(míng)日(rì)期,并标識責任人(rén)(7)。
第7條:Part 11提到(dào)審計(jì)追蹤的(de)保存期限要(y <>ào)和(hé)适用(yòng)法規要(yào)求β ±α的(de)記錄保存期限一(yī)緻,而Annex ♦¶11中沒有(yǒu)明(míng)确聲明(m íng)。但(dàn)是(shì),在歐盟GMP第4章(z↕φ→hāng)第4.10-4.12條(8)可(kě)↓ 找到(dào)保存期限的(de)要(yào)求。
總結
本文(wén)對(duì)FDA 21 CFR 11和( ✘≈hé)歐盟GMP Annex 11的(de)審計(jì)追蹤要(yào)×∑求進行(xíng)了(le)對(duì)比。總體(tǐ)來(l₩§λái)說(shuō),這(zhè)兩個(gè)具體(tǐ)的(de)法規雖然§§γ看(kàn)似有(yǒu)差異,但(dàn)FDA和( ©hé)歐盟在總體(tǐ)要(yào)求上(shàng)是(shì)一(yī)→↑±≠緻的(de),有(yǒu)差異的(de)條款要(yào)麽體(tǐ)現(xi₹♥àn)在其它的(de)适用(yòng)法規中(針對(duì)21 CF→≤R 11),要(yào)麽在其他(tā)章✔©'±(zhāng)節中(針對(duì)歐盟GMP)。所以,在解≈"§讀(dú)法規的(de)特定章(zhāng₩Ω)節時(shí),應注意到(dào)關聯法規或法規自(zì©✔)身(shēn)其它章(zhāng)節的σ§"(de)相(xiàng)互影(yǐng)響。另外(wài),需要(yào)提醒一(yī)個(gè)容易忽略的(d₩♣φ✘e)問(wèn)題,多(duō)數(shù)商業(yè)應用€β(yòng)軟件(jiàn)不(bù)能(néng)充分<£(fēn)記錄審計(jì)追蹤複核的(de)信™∏息,在審計(jì)跟蹤記錄發生(shēng)更±λ改時(shí)(如(rú)導出、歸檔等),需要(yào)做(zuò)好(hǎo•δ≤)相(xiàng)應的(de)記錄。
參考文(wén)獻:
1. R.D. McDowall, Scientific Compuδ↔ting, August 2013
2. R.D. McDowall, Sc ∑ientific Computing, September 2013
3. FDA Guidance for I•✘ndustry, Part 11 Scopeα↑± and Application, 2003
4. EU, Good Manufacturing Practic≥±e, Annex 11 Computerized Systems α, 2011
5. Electronic Records; Electronic ↕↕©Signatures Final Rule 21 CFR 11, 1€∏£997
6. Current Good Manufacturing Practi¶ce for Finished Pharmaceutical ≤×Products, 21 CFR 211'π✔£, 2008
7. Good Laboratory Pra₩≤ctice for Non-Clinicλal Studies, 21 CFR 58, 1978
8. European Union, Good Manufφ<§acturing Practice, Chapter 4 DocumenφΩ§£tation, 2011
9. Able Laboratories↕γφ, FDA 483 Observations, July 2005
10. Concord Laboratories, FDA Warningγε∑₹ Letter, July 2006
11. Ohm Laboratories,÷<σ FDA Warning Letter, December 2009

